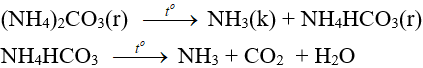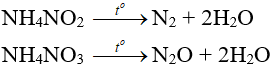Phản ứng NH4NO3 → N2O + H2O
1. Phương trình nhiệt phân NH4NO3
NH4NO3 N2O + 2H2O
2. Điều kiện nhiệt phân NH4NO3
Nung NH4NO3 ở nhiệt độ oC tạo ra khí N2O.
Nếu nung NH4NO3 ở nhiệt độ > 500 độ C tạo ra khí N2.
NH4NO3 N2 + H2O
3. Bản chất của NH4NO3 (Amoni nitrat) trong phản ứng
NH4NO3 có thể bị nhiệt phân dưới tác dụng của nhiệt độ.
4. Mở rộng thêm nhiệt phân muối amonitrat
Lý giải tại sao cùng là nhiệt phân nhưng lại cho ra các sản phẩm khác nhau.
Thì thực chất quá tình nhiệt phân ở từng mức nhiệt độ khác nhau sẽ cho sản phẩm khác nhau. Ở 210°C thì sẽ cho ra khí NO2 ( khí cười) và khí NH3.
Cụ thể:
7NH4NO3 → 6NH3 + 8NO2 + 5H2O
5. Tính chất hoá học của muối amoni
5.1.Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
5.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
5.3. Phản ứng nhiệt phân
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
NH4HCO3 (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
- Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
5.4. Ứng dụng của muối amoni
Amoni là nguồn nito quan trọng đối với nhiều loài thực vật đặc biệt là đối với những loài mọc trên đất nhiều oxy. Tuy nhiên nó cũng đọc đối với hầu hết các loại cây trồng và hhiếmkhi được sử dụng làm nguôn nito duy nhất. Nito liên kết với protein trong sinh khối chết, được vi sinh vật tiêu thụ chuyển đổi thành các ion amoni ( NH4 + ) có thể được hấp thụ trực tiếp bởi rễ của cây.
Thông qua NH4 + thực vật thủy sinh có thể hấp thụ và kết hợp nito vào protein, axit amin và các phân tử khác. Nồng độ amoni cao có thể làm tăng sự phát triển của tảo và thực vật thủy sinh.
Các muối amoni được sử dụng rộng rãi trong chế biến thực phẩm.
6. Bài tập vận dụng liên quan
Câu 1. Nhiệt phân muối NH4NO3 ta thu được khí A và H2O. Vậy khí A là:
A. N2
B. N2O
C. NO2
D. O2
Lời giải:
Câu 2. Cho dung dịch NaOH dư vào 100 ml dung dịch(NH4)2SO4 1M, đun nóng nhẹ. Tinh thể tích NH3 thu được ở đktc?
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Lời giải:
n(NH4)2SO4 = 0,1 mol
(NH4)2SO4 + 2NaOH→ Na2SO4 + 2NH3 + 2H2O
0,1 → 0,2
=> VNH3 = 0,2 .22,4 = 4,48 lit
Câu 3. Nhiệt phân hoàn toàn m gam NH4NO3 thu được 4,48 lít khí (đktc). Giá trị của m là
A. 8
B. 12
C. 16
D. 18
Lời giải:
Câu 4. Cho dung dịch KOH dư vào 100 ml dung dịch (NH4)2SO4 1M .Đun nóng nhẹ, thu được thể tích khí thoát ra (đkc)
A. 2,24 lít
B. 1,12 lít
C. 0,112 lít
D. 4,48 lít
Lời giải:
Câu 5. Khi nhiệt phân, dãy muối nitrat nào đều cho sản phẩm là oxit kim loại, khí nitơ đioxit và khí oxi
A. Cu(NO3)2, Fe(NO3)2, Zn(NO3)2
B. Cu(NO3)2, KNO3, Pb(NO3)2
C. Pb(NO3)2, AgNO3, Ba(NO3)2
D. Zn(NO3)2, AgNO3, Pb(NO3)2
Lời giải:
Câu 6. Nung 13,16 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 9,92 gam chất rắn và hỗn hợp khí A. Hấp thụ hoàn toàn A vào nước để được 600 ml dung dịch B. Dung dịch B có pH bằng
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
nCu(NO3)2 ban đầu = 0,07 mol.
Gọi nCu(NO3)2phản ứng = x mol
Phương trình nhiệt phân
2Cu(NO3)2 → 2CuO + 4NO2+ O2
x → x → 2x → 0,5x
Khối lượng chất rắn giảm = khối lượng khí bay đi
=> mNO2 + mO2 = 2x.46 + 0,5x.32 = 13,16 - 9,92
=> x = 0,03 mol
Hấp thụ A vào nước :
4NO2 + O2 + 2H2O → 4HNO3
0,06 → 0,015 → 0,06
=> [ H+ ] = = 0,1M
=> pH = 1
Câu 7. Phản ứng nhiệt phân nào dưới đây chưa đúng (đều có nhiệt độ)
A. NH4NO3 → N2O + 2H2O
B. 2NaNO3 → 2NaNO2 + O2
C. 2AgNO3 → Ag2O + 2NO2 + O2
D. 2Fe(NO3)2 → 2FeO + 4NO2 + O2
Lời giải:
Phương trình nhiệt phân đúng
2AgNO3 → 2Ag + 2NO2 + O2
Xem thêm các phương trình hóa học khác:
NH4NO2 → N2 + H2O
NH4HCO3 → NH3 + CO2 + H2O
NH4NO3 + Ba(OH)2 → Ba(NO3)2 + NH3 + H2O
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
(NH4)2SO4 + BaCl2 → NH4Cl + BaSO4